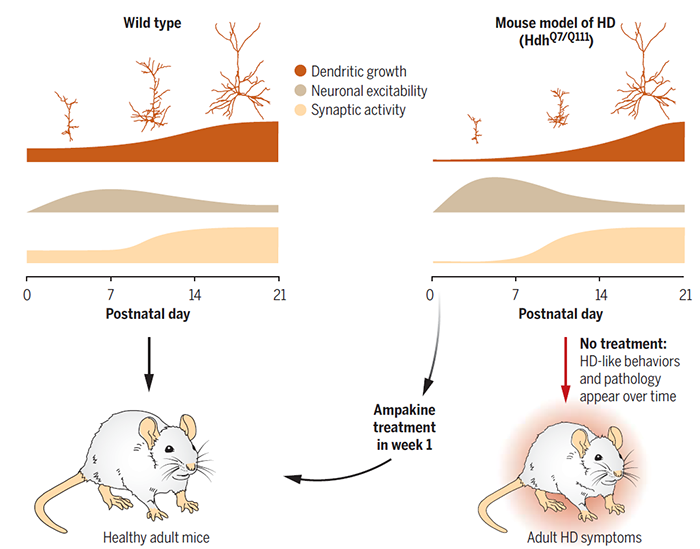
亨廷顿病(HD)是一种神经退行性疾病,患者会出现运动、认知和精神障碍,症状通常会在三十岁至五十岁首次出现,从疾病出现到死亡的时间通常是十年到三十年,目前对于HD仍没有有效的疗法。亨廷顿蛋白(HTT)是一种参与细胞内物质运输的支架蛋白,突变形式的HTT会导致HD,此外,HTT也参与神经发育过程【1】。由于HD是一种晚发性疾病,因此在HD模式小鼠中观察到的胚胎发育缺陷常常被认为与疾病无关。但是,很多神经退行性疾病,如阿尔兹海默病和帕金森病,都在早期发育过程就有了蛛丝马迹【2】。那么,HD是否也存在一个发育窗口期,在这个时期内神经发育异常,使得患者更易发病呢?近日,来自法国Grenoble神经科学研究所的Sandrine Humbert研究团队在Science上发表题为Treating early postnatal circuit defect delays Huntington’ disease onset and pathology in mice的文章,发现在出生后第一周,HD模式小鼠皮层2/3层的兴奋性突触活性较低,谷氨酸能受体表达低,并表现出感觉运动缺陷,但是在第二周时,这些缺陷可以被自我修复,回到正常水平。在新生时期用药物加强谷氨酸能突触传递可以挽救这些神经缺陷,改善成年时期HD模式小鼠的感觉运动和认知功能。Sandrine Humbert研究团队之前的研究工作发现,HD模式小鼠很早就会出现皮层前体细胞分裂、神经迁移、树突成熟和轴突生长缺陷[3–5],他们猜测这可能是突触信号传递和神经兴奋性的变化所导致的。于是他们首先在HD模式小鼠的皮层中检测了兴奋性谷氨酸能神经元的自发性兴奋性突触后电流(sEPSC)和微小兴奋性突触后电流(mEPSC),发现与野生型相比,HD模式小鼠的sEPSC和mEPSC的频率和mEPSC的振幅在出生后第1天到第3天(P1-P3)较低,而在第7-10天,HD模式小鼠的mEPSC和sEPSC的频率恢复正常,但振幅更高,到了第21-26天,频率和振幅都恢复正常。AMPA谷氨酸受体介导快速的兴奋性突触信号传递,他们发现HD模式小鼠在第2天时,AMPA受体亚基GluA1表达量下降,而在第8天时又恢复正常。接下来,他们检测了皮层2/3层的兴奋性,发现在第1-3天时,只有30%的神经元可以在电流注入时产生动作电位,这一比例随着年龄逐渐增加,但是随着神经元的成熟,它们变得更加不易兴奋,基强度(引起动作电位所需的最小电流)随着年龄逐渐增大。在第4-6天时,HD模式小鼠的神经元兴奋性更强,表现为更高的峰值反应和更低的基强度,而到第21-26天时恢复正常。因此,新出生的HD模式小鼠神经元会出现短暂的神经环路生理变化,随后可能通过代偿效应恢复到正常水平。本研究使用的HD模式小鼠是基因敲入小鼠(HdhQ7/Q111),携带有一个拷贝的野生型HTT和一个突变形式的HTT,一般认为HD是由于突变形式的HTT造成了功能获得性突变,但是研究人员发现,敲除野生型HTT也会导致类似于HD的表型,并且HD模式小鼠中,野生型HTT拷贝的存在对于其早期的神经缺陷的恢复是必需的。由于谷氨酸能突触传递参与树突成熟过程,研究人员于是检测了树突的形态,发现在早期,HD神经元的一级树突数目与野生型相同,但是树突更短也更简单,到了第21天时,则和野生型没有差别,说明HD模式小鼠的神经元树突成熟过程延迟。接下来,为了研究加强谷氨酸能突触传递是否可以挽救HD小鼠的表型,他们用一种药物,安帕金CX516,加强谷氨酸能突触传递,通过在胚胎15.5天进行子宫内电穿孔以及出生后一周每天皮下注射两次CX516,发现可以挽救HD模式小鼠的树突成熟延迟。为了进一步研究CX516是否会影响HD模式小鼠的感觉运动功能,研究人员检测了小鼠早期的抱团(huddling)行为,发现HD模式小鼠的抱团能力较弱,而CX516处理可以挽救HD模式小鼠的抱团缺陷。此外,HD模式小鼠的翻正反射所需时间也更长,CX516处理也可以挽救这一缺陷。因此,加强谷氨酸能突触传递可以挽救HD模式小鼠的感觉运动缺陷。为了检测CX516处理是否会影响HD的进程,研究人员对新出生的小鼠进行每天两次皮下注射CX516,共注射一周,然后分别在第5周、2个月、6个月时分别进行相关行为学实验,发现早期CX516处理可以延缓成年后HD相关行为缺陷的出现。在第8个月进行组织学和核磁共振成像检测,发现CX516处理可以挽救HD模式小鼠脊髓树突和兴奋性突触的密度,大脑纹状体、皮层和下丘脑的体积变化也有所恢复。因此,出生后早期进行CX516处理可以延缓HD进程。总的来说,这项研究发现,HD模式小鼠在出生后,神经环路活动会出现短暂的上升或者下降,潜移默化地影响大脑的结构和功能,而这些影响可能直到成年后才会表现出来。他们的实验结果表明,对新生儿进行早期治疗可能可以改变疾病的进程,因此,这项研究为开发新的HD治疗策略提供了思路和理论基础。https://doi.org/10.1126/science.abq50111. Barnat, M. et al. Huntington’s disease alters human neurodevelopment. Science 369, 787–793 (2020).2. Stephens, M. C., Brandt, V. & Botas, J. The developmental roots of neurodegeneration. Neuron 110, 1–3 (2022).3. Molina-Calavita, M. et al. Mutant huntingtin affects cortical progenitor cell division and development of the mouse neocortex. J. Neurosci. Off. J. Soc. Neurosci. 34, 10034–10040 (2014).4. Barnat, M., Le Friec, J., Benstaali, C. & Humbert, S. Huntingtin-Mediated Multipolar-Bipolar Transition of Newborn Cortical Neurons Is Critical for Their Postnatal Neuronal Morphology. Neuron 93, 99–114 (2017).5. Capizzi, M. et al. Developmental defects in Huntington’s disease show that axonal growth and microtubule reorganization require NUMA1. Neuron 110, 36-50.e5 (2022).